Exercício sobre distribuição eletrônica (com gabarito resolvido)
A distribuição eletrônica é o processo pelo qual pode-se entender a dinâmica e comportamento dos elétrons em um elemento. Dessa maneira, compreende-se os tipos de ligações químicas que serão realizadas através da teoria dos elétrons de valência.
Pratique os seus conhecimentos com os 4 exercícios abaixo.
Questão 1
Qual é a distribuição eletrônica correta para um átomo de enxofre (Z = 16) no estado fundamental?
a) 1s² 2s² 2p⁶ 3s² 3p⁴
b) 1s² 2s² 2p⁶ 3s² 3p⁶
c) 1s² 2s² 2p⁶ 3s² 3p²
d) 1s² 2s² 2p⁶ 3s² 3p³
e) 1s² 2s² 2p⁶ 3s² 3d²
Resposta correta: letra a - e) 1s² 2s² 2p⁶ 3s² 3p4.
Quando realizamos a distribuição seguindo o diagrama de energia conforme a imagem abaixo:
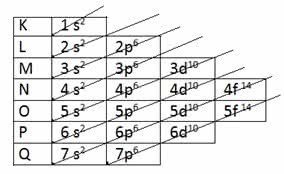
Seguindo as setas (vetores) em diagonal, temos que:
1s2 2s2 2p6 3s2 3p4
ou seja, somando os expoentes que são, verdade, a quantidade de elétrons possíveis em cada subcamada (s, p, d, f) contabilizaremos 16 elétrons no total.
Uma vez que temos um elemento no seu estado fundamental, isto é, sem carga positiva ou negativa (íons) o número de prótons, que é igual ao número atômico (Z), será igual ao número de elétrons. Dessa maneira, precisamos realizar a distribuição de 16 elétrons, conforme demonstra o enunciado.
Questão 2
De acordo com a regra de Hund, como os elétrons se distribuem em orbitais degenerados?
a) Os elétrons ocupam os orbitais de um subnível de forma emparelhada antes de preencher os orbitais vazios
b) Os elétrons ocupam os orbitais de um subnível de forma desemparelhada, com spins paralelos, antes de se emparelhar
c) Os elétrons preenchem primeiro os orbitais de maior energia antes dos de menor energia
d) Os elétrons podem se distribuir de qualquer forma, sem seguir um padrão específico
e) Nenhuma das alternativas anteriores
Resposta correta: letra b - Os elétrons ocupam os orbitais de um subnível de forma desemparelhada, com spins paralelos, antes de se emparelhar.
A regra de Hund diz que:
"Os pares de spins (elétrons) só serão formados a partir do momento que todos os orbitais de um determinado subnível forem ocupados".
Por exemplo, no subnível p existem três orbitais, cada um cabendo um par de elétrons totalizando 6 elétrons no total.
Porém, para que os três orbitais estejam completos em pares, primeiramente ocorre a distribuição de spins para todos os três orbitais. Conforme a figura abaixo
Questão 3
O princípio da exclusão de Pauli afirma que:
a) Que a camada de valência não define os processos de ligação química
b) Os elétrons sempre preenchem os orbitais em ordem crescente de energia
c) Um orbital pode conter até três elétrons, desde que tenham spins diferentes
d) Os elétrons sempre preenchem um orbital completamente antes de passar para o próximo
e) Um orbital pode conter no máximo dois elétrons, com spins opostos
Resposta correta: letra e - Um orbital pode conter no máximo dois elétrons, com spins opostos.
O princípio de exclusão de Pauli afirma que dentro de um orbital atômico não é possível coexistir elétrons com o mesmo valor de números quânticos. Ou seja, só pode haver dois elétrons com spins invertidos, sugerindo cargas opostas (+1/2 e -1/2).
Questão 4
Qual das alternativas apresenta a ordem correta de preenchimento dos orbitais segundo o diagrama de Linus Pauling?
a) 1s → 2s → 2p → 3s → 3p → 3d → 4s → 4p → 4d
b) 1s → 2s → 2p → 3s → 3p → 4s → 4p → 3d → 5s
c) 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s
d) 1s → 2s → 2p → 3s → 3p → 3d → 4s → 4p → 5s
e) 1s → 2s → 2p → 3s → 3p → 3d → 4s → 4p → 4d
Resposta correta: letra c - 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s.
O diagrama de energia segue o princípio de Aufbau. Esse princípio diz que os elétrons tendem a ocupar os orbitais, primeiramente, de menor energia.
É o que a contece entre os níveis e subníveis 3p para 4s. Como 3d representam nível e subnível de maior energia, primeiro os elétrons ocupam o nível 4 em seu primeiro subnível (s) para depois distribuírem-se pelo nível 3, subnível d.
Você pode continuar praticando sobre Distribuição Eletrônica: Neste conteúdo do Toda Matéria.
Saiba mais sobre o tema: Diagrama de Linus Pauling.
- Diagrama de Linus Pauling
- Significado do Arco-íris
-
Exercícios sobre as Leis de Newton para praticar (com respostas explicadas)

-
Exercícios sobre a estrutura das palavras para estudar (com gabarito)

- Cátions e Ânions
-
Exercício sobre estequiometria para estudar (com respostas explicadas)

-
Exercício sobre química orgânica (com questões resolvidas e explicadas)

-
Átomos

-
Ouro

- Ponto de fusão
